MycoLight 荧光活/死细菌成像试剂盒
| Ex (nm) | - | Em (nm) | - |
| 分子量 | - | 溶剂 | - |
| 存储条件 | - |
产品货期
咨询
产品优势
提供双色荧光检测方案,可通过荧光显微镜直观区分活菌与死菌
适用范围
活/死菌荧光成像
产品介绍
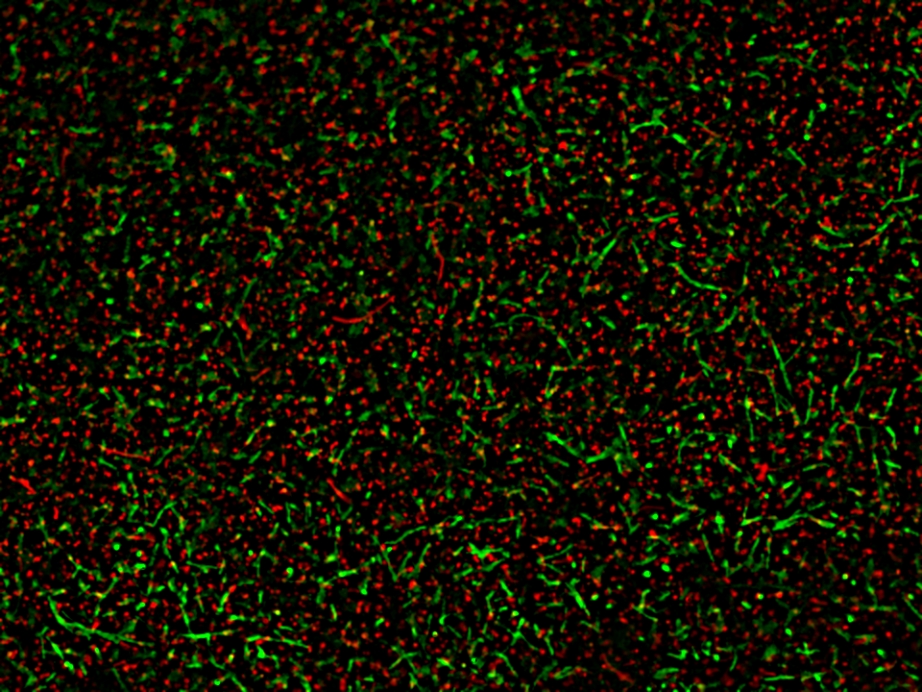
AAT Bioquest的MycoLight™荧光活/死菌成像试剂盒提供双色荧光检测方案,可通过荧光显微镜直观区分活菌与死菌。该试剂盒包含的MycoLight™ 520是一种非荧光酯酶底物,可渗透至革兰氏阳性菌与阴性菌内部,经细菌细胞内非特异性酯酶水解后生成绿色荧光产物并累积于菌体内;而碘化丙啶作为红色荧光核酸染料,仅能进入细胞膜受损的细菌。
通过优化配比的MycoLight™ 520与碘化丙啶混合染料,具有完整细胞膜的活菌呈现绿色荧光,细胞膜受损的死菌则显示红色荧光。该试剂盒是进行活/死菌荧光成像的可靠工具,染色后的细菌可分别通过FITC滤光片组(活菌)和TRITC滤光片组(死菌)进行荧光观测。
适用仪器
| 荧光显微镜 | |
| Ex: | 488/540 nm |
| Em: | 530/620 nm |
| 推荐孔板: | 黑色透明底板 |
| 通道: | FITC/TRITC 通道 |
染色样品示例
概述
1.配制100X MycoLight™ 520储备液
2.准备细菌样本
3.加入MycoLight 520和碘化丙锭
4.将细菌样品与MycoLight 520和碘化丙啶在37°C孵育5-10分钟或在室温下孵育60分钟
5.用FITC和TRITC滤光片组通过荧光显微镜分析样品
注意:在开始实验之前,在室温下解冻所有试剂盒组分
操作步骤
储备液配制
除非另有说明,所有储备液应分装为单次用量并于-20°C冻存,避免反复冻融。
MycoLight™ 520储备液(100X)
向MycoLight™ 520(组分A)瓶中加入100 µL DMSO(组分D)。
*注:储备液需-20°C避光保存,避免反复冻融。*
实验操作步骤
细菌样本制备
1.将细菌培养至对数生长后期,调整浓度至10⁶–10⁸ cells/mL。
*注:可通过OD600值换算细胞数(大肠杆菌OD600=1.0约等于8×10⁸ cells/mL)*
2.离心去除培养基(10,000 × g,10分钟),用Assay Buffer(组分C)重悬菌体。
3.死菌对照可通过70%乙醇处理30分钟后再沸水浴60分钟制备。
染色流程
注:以下为建议方案,请根据菌株特性或实验需求优化。若背景荧光过高,可在成像前增加洗涤步骤。
1.向100 µL菌悬液中加入1 µL 100X MycoLight™ 520储备液与1 µL 100X碘化丙啶(组分B)。
2.充分混匀后避光孵育:37°C孵育5-10分钟,或室温孵育60分钟。
3.通过FITC通道(Ex/Em=488/530 nm)与TRITC通道(Ex/Em=540/620 nm)观察细菌荧光。