Cell Meter 固定细胞和组织TUNEL细胞凋亡测定试剂盒*深红色荧光*
| Ex (nm) | 649 | Em (nm) | 663 |
| 分子量 | - | 溶剂 | Water |
| 存储条件 | 在零下15度以下保存, 避免光照 |
产品货期
咨询
适用范围
适用于固定细胞样本以及福尔马林固定、石蜡包埋组织切片的凋亡研究
产品介绍
Cell Meter™固定细胞和组织TUNEL细胞凋亡检测试剂盒为DNA片段引起的细胞凋亡检测提供了一种便捷、快速且非放射性的高效工具。
TUNEL 检测利用末端脱氧核苷酸转移酶(TdT)催化TMR-dUTP标记物在DNA片段3'-羟基末端的特异性掺入,生成的TMR荧光标记DNA可通过荧光显微镜(Cy5滤光片组)或633或640 nm激光和660/20 nm滤光片(APC通道)进行流式细胞术分析。其红色荧光发射特性可轻松实现与GFP标记靶标的多元检测。直接掺入TMR荧光标记核苷酸的设计显著减少了实验步骤。
Cell Meter™固定细胞和组织TUNEL细胞凋亡检测试剂盒经过优化,适用于固定细胞及福尔马林固定、石蜡包埋组织切片的凋亡检测。
适用仪器
| 流式细胞仪 | |
| Ex: | 633/640 nm |
| Em: | 660/20 nm |
| 通道: | APC 通道 |
|
荧光显微镜 |
|
| Ex: | Cy5 滤波片组 |
| Em: | Cy5 滤波片组 |
| 推荐孔板: | 黑色透明底板 |
样品分析方案
概述
根据需要处理样品
在冰上用4%甲醛溶液固定细胞30分钟
在冰上用70%冰冷的乙醇透化细胞60分钟
将TdT染色溶液添加到样品中并在37°C下孵育60分钟
使用带有Cy5滤光片组的荧光显微镜检测荧光强度
工作溶液配制
45 µL TdT反应缓冲液(组分D)
5 µL CoCl2(组分C)
0.5 µL TF5-dUTP(组分B)
0.5 µL TdT酶(组分A)。
注意:TdT染色溶液应立即使用。
操作步骤
以下方案可用作参考,实际情况应根据需要进行调整。
1.根据需要处理样品。
2.用您选择的缓冲液(例如含Ca+2和Mg+2的PBS)洗涤样品。
3.通过在PBS中加入100 µL 4%多聚甲醛固定样品,并在冰上孵育30分钟。
4.除去固定液并用PBS洗涤样品。
5向样品中加入100 µL 70%的冰冷乙醇,并在冰上孵育60分钟。
注意:样品在使用前可以在-20°C下保存几天。
6除去酒精并用PBS洗涤细胞。
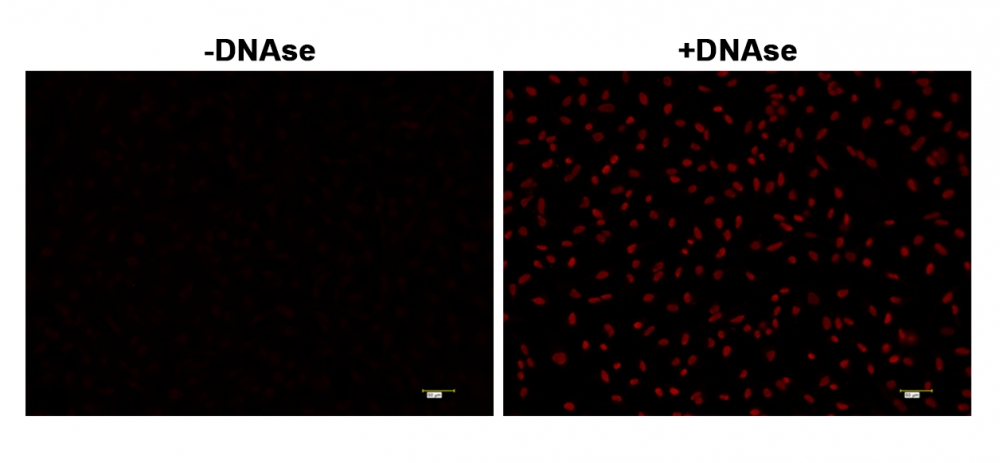
注意:对于阳性对照,将固定样品与2-5 µg / mL DNAse在含有Ca +2和Mg +2的PBS中于37°C 孵育60分钟。除去DNAse并彻底清洗细胞,并继续进行其余操作。
7.向样品中加入50µL TdT染色溶液,并在37°C下孵育60至120分钟。
8.除去TdT工作溶液,并用PBS洗涤样品。
9.将样品重悬于PBS中,并使用流式细胞仪使用660/20 nm滤光片(APC通道)或带有Cy5滤光片组的荧光显微镜检测荧光强度。
组织染色方案
脱蜡复水流程
1.将载玻片置于Coplin广口瓶中,新鲜二甲苯浸泡5分钟(室温),从而对组织切片(附着在载玻片上)进行脱蜡,重复一次(共2次洗涤)
2.将载玻片在室温下在Coplin广口瓶中浸入100%乙醇中5分钟,以洗涤样品。
3.通过在室温下将载玻片依次浸入不同浓度乙醇:(100%,95%,85%,70%,50%)中,然后分别在室温下浸没5分钟,使样品重新水化。
4.在室温下将载玻片浸入0.85%NaCl中5分钟,以洗涤样品。
5.在室温下将载玻片浸入PBS中5分钟,以洗涤样品。重复一遍。(共2次洗涤)
固定方案
1.通过在室温下将载玻片浸入PBS中的4%多聚甲醛溶液中15-20分钟来固定组织切片。
2.在室温下将载玻片浸入PBS中5分钟,以洗涤样品。重复一遍。(共2次洗涤)
3.除去液体,然后将载玻片放在平坦的表面上。用100 µL 20 µg / mL蛋白酶K溶液处理组织切片。添加足够覆盖整个组织表面。在室温下孵育载玻片10分钟。
4.在室温下将载玻片浸入PBS中5分钟,以洗涤样品。
5.通过在室温下将载玻片浸入PBS中的4%多聚甲醛溶液中15-20分钟来固定组织切片。
6.在室温下将载玻片浸入PBS中5分钟,以洗涤样品。重复一遍。(共2次洗涤)
染色方案
可选:对于阳性对照,将固定的样品与2-5 µg / mL的DNAse在含有Ca +2 和Mg +2的PBS中于37°C 孵育60分钟。除去DNAse,并用PBS彻底清洗细胞,并继续进行其余操作。
向样品中加入50 µL TdT染色溶液,并在37°C下孵育60至120分钟。
除去TdT工作溶液,并用PBS洗涤样品。
加入含DAPI的封固剂(AAT Bioquest Cat#20005),并用Cy5滤光片组检测荧光强度荧光显微镜