Cell Meter 荧光法细胞电压检测试剂盒
| Ex (nm) | - | Em (nm) | - |
| 分子量 | - | 溶剂 | - |
| 存储条件 | - |
产品货期
咨询
适用范围
监测细胞膜电位变化,适用于调控离子通道化合物的筛选。
产品介绍
几乎所有细胞质膜都存在跨膜电位,通常表现为膜内侧相对外侧呈负电位。当膜上某处离子通道开启或关闭时,会引发局部膜电位变化从而产生信号。这种电场变化能迅速影响相邻或远端离子通道,导致这些通道随电位变化而启闭,实现信号传递。
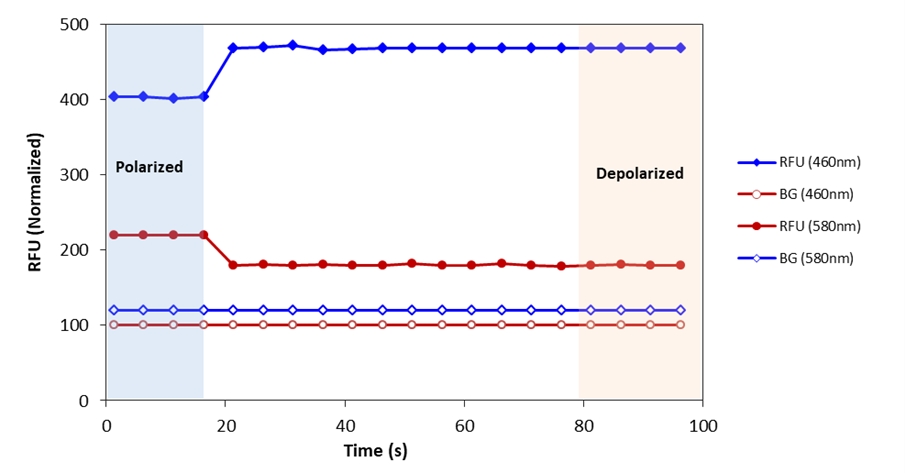
Cell Meter™荧光法细胞电压检测试剂盒采用FRET荧光对(VSB 405与VSR 555)监测细胞膜电位变化。疏水性探针VSB 405主要定位于脂膜外层,而VSR 555的定位则对膜电位高度敏感。静息状态下,膜内层负电位使VSR 555紧邻细胞膜外层分布,与蓝色荧光探针VSB405近距离结合,从而高效实现从蓝光(VSB 405)到红光(VSR 555)的荧光共振能量转移。当细胞去极化时,VSR 555向膜内层迁移,导致FRET对分离且能量转移中断。蓝光/红光荧光强度比与细胞电压呈正相关。本检测体系适用于调控离子通道化合物的筛选。
适用仪器
荧光酶标仪
| Ex: | 405 nm |
| Em: | 460 nm and 580 nm |
| Cutoff: | 435 nm and 515 nm |
| 推荐孔板: | 黑色透明底板 |
| 读取模式: | 底读模式/分液处理 |
其他仪器
ArrayScan, FDSS, FLIPR, FlexStation, IN Cell Analyzer, ViewLux实验步骤摘要
1.按需培养细胞
2.加入VSB405负载溶液,室温孵育45分钟
3.移除VSB405负载溶液,用Voltage Assay Buffer I洗涤细胞
4.加入VSR555负载溶液,室温孵育15分钟
5.在加入去极化刺激剂前后,分别测定Ex1/Em1 = 405/460 nm和Ex2/Em2 = 405/580 nm的荧光响应
注意事项
实验开始前,请将试剂盒所有组分平衡至室温。
标准操作说明
(除非特别说明,所有未使用的母液均应分装为单次用量,配制后保存于-20°C,避免反复冻融)
储备溶液配制
VSB405储备溶液(100X)
向VSB405(组分A)中加入100 µL DMSO(组分F),混匀。
*注:未使用的VSB405母液需分装保存于-20°C*
注:在指定储存条件下,VSB405母液可稳定保存至少1个月
VSR555储备溶液(100X)
向VSR555(组分C)中加入100 µL DMSO(组分F),混匀。
*注:未使用的VSR555母液需分装保存于-20°C*
注:在指定储存条件下,VSR555母液可稳定保存至少1个月
工作液配制
VSB405工作液
向1 mL Voltage Assay Buffer I(组分D)中加入10 µL 100X Pluronic® F127(组分B),混匀后加入10 µL VSB405母液,充分混合。
注:VSB405负载工作液需现配现用,不可储存
VSR555工作液
向1 mL Voltage Assay Buffer II(组分E)中加入10 µL VSR555母液,混匀。
注:VSR555负载工作液需现配现用,不可储存
标准实验方案
以下方案可作为操作指南,请根据实际需求进行优化
1.按实验需求培养细胞
2.移除细胞培养基,加入100 µL Voltage Assay Buffer I(组分D)
3.立即吸除缓冲液
注:无需使用Voltage Assay Buffer I进行孵育或震荡
4.每孔加入100 µL VSB405工作液,室温避光孵育45分钟(培养板需加盖避光)
5.移除VSB405工作液,使用100 µL Voltage Assay Buffer I洗涤细胞,吸除洗涤缓冲液
6.每孔加入100 µL VSR555工作液,室温避光孵育15分钟
7.使用酶标仪检测(参数设置:Ex1/Em1=405/460 nm;Ex2/Em2=405/580 nm)
检测流程:
a) 先测定静息电位状态读数
b) 注入去极化缓冲液(如高钾缓冲液)
c) 进行连续多次读数
*重要提示:
待测化合物应在VSR555负载后立即加入
刺激剂需在数据采集过程中加入*