Cell Meter 活细胞Caspase 13结合检测试剂盒 绿色荧光
| Ex (nm) | 493 | Em (nm) | 517 |
| 分子量 | - | 溶剂 | Water |
| 存储条件 | 在零下15度以下保存, 避免光照 |
产品货期
咨询
产品优势
兼容荧光显微镜、流式细胞仪或荧光酶标仪
适用范围
用于细胞凋亡检测
产品介绍
Cell Meter™活细胞半胱天冬酶活性检测试剂盒采用荧光FMK半胱天冬酶抑制剂的检测原理。该抑制剂具有细胞膜通透性和非细胞毒性特性,进入细胞后可共价结合活性半胱天冬酶。
Cell Meter 活细胞Caspase 13结合检测试剂盒专为通过检测活细胞中caspase 13的活化水平来监测细胞凋亡而设计,适用于定量分析凋亡细胞的caspase 13活性,或用于筛选caspase 13抑制剂。试剂盒中的绿色荧光标记物 FAM-LEED-FMK可直接通过荧光显微镜、流式细胞仪或荧光酶标仪检测凋亡细胞中激活的caspase 13。本试剂盒提供所有必需组分及经过优化的检测方案。
| 流式细胞仪 | |
| 激发: | 见表1 |
| 发射: | 见表1 |
| 荧光显微镜 | |
| 激发: | 见表1 |
| 发射: | 见表1 |
| 推荐孔板: | 黑色透明 |
| 荧光酶标仪 | |
| 激发: | 见表1 |
| 发射: | 见表1 |
| 通道: | 黑色透明 |
| 读取模式: | 底读模式 |
表1:参数信息
| FAM-LEED-FMK | 碘化丙啶 | hoechst 染料 | |
| 流式细胞仪 | 530/30 nm激光 (FITC 通道) | 610/20 nm激光(PE-Texas Red 通道) | 450/40 nm激光 (Pacific Blue 通道) |
| 荧光显微镜 | FITC 通道 | TRITC 通道 | DAPI 通道 |
| 荧光酶标仪 | 490/525nm | 535/635nm | 350/461nm |
分离细胞的检测方案
概述
1.用测试化合物制备细胞,密度为5×105至2×106个细胞/ mL
2.按 1:150 的比例向细胞溶液中加入FAM-LEED-FMK
3.室温孵育1小时
4.离心收集细胞,洗涤后用缓冲液或生长培养基重悬
5.荧光强度检测(底部读数模式):Ex/Em=490/525 nm(截止波长515 nm)
荧光显微镜:使用FITC滤光片
流式细胞仪:488 nm 激光和 530/30 nm 滤光片(FITC 通道)
注:使用前将所有部件在室温下解冻。
储备溶液配制
除非另有说明,所有未使用的储备液应分装成单次使用量,制备后储存在 - 20°C。避免反复冻融。
FAM-LEED-FMK储备液(150X):
向FAM-LEED-FMK(组分 A)的小瓶中加入 50 µL 二甲基亚砜(DMSO),配制 150XFAM-LEED-FMK储备液
有关细胞样品制备
请访问:https://www.aatbio.com/resources/guides/cell-sample-preparation.html
实验方案
1.根据特定的诱导方案培养细胞至适合凋亡诱导的密度,但不超过 2×10⁶个细胞 /mL。同时,对于每种标记条件,培养与诱导组密度相同的未诱导阴性对照细胞群。以下是一些诱导悬浮培养细胞凋亡的例子:
1)用2μg/ ml喜树碱处理Jurkat细胞3小时。
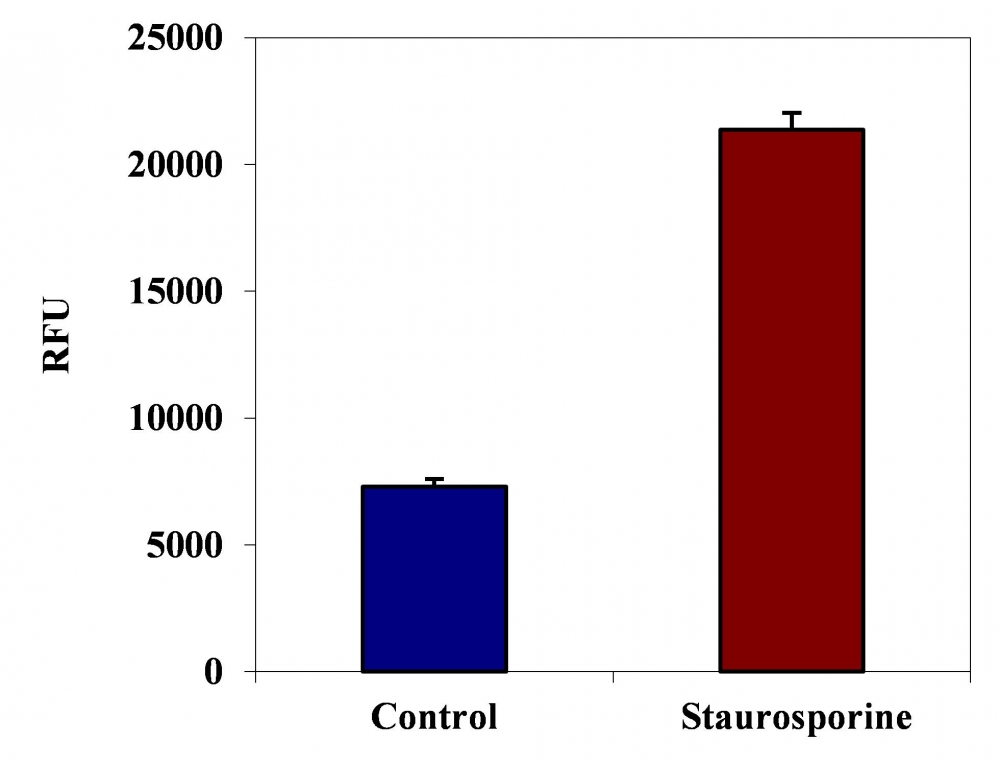
2)用1μM星形孢菌素处理Jurkat细胞3小时。
3)用4μg/ ml喜树碱处理HL-60细胞4小时。
4)用1μM星形孢菌素处理HL-60细胞4小时。
注意:应对每个细胞系进行单独评估,以确定诱导细胞凋亡的细胞密度。
2.按 1:150 的比例向细胞溶液中加入 150X FAM-LEED-FMK储备液,将细胞置于 37°C、5% CO₂培养箱中孵育 1 小时。
注 a.用于FAM-LEED-FMK标记的细胞可浓缩至约 5×10⁶个细胞 /mL。
b.对于贴壁细胞,用 0.5 mM EDTA 轻轻吹打细胞以保持细胞完整,在与FAM-LEED-FMK孵育前用含血清的培养基洗涤细胞一次。
c.合适的孵育时间取决于所用的细胞类型和细胞浓度,需为每个实验优化孵育时间。
3.以约 200g 的离心力离心细胞 5 分钟,用 1 mL 洗涤缓冲液(组分 B)洗涤细胞两次,然后将细胞重悬于适量的洗涤缓冲液中。
注1:FAM-LEED-FMK具有荧光,因此必须洗去所有未结合的试剂以消除背景干扰。对于悬浮细胞,应将细胞浓度调整为每块微量滴定板的每个孔中 2-5×10⁵个细胞 / 100 µL。
4.如果需要,可用DNA染色标记细胞(例如用 碘化丙啶标记死细胞,或用 Hoechst 标记全细胞群的细胞核)
5.通过荧光显微镜、流式细胞仪或荧光酶标仪监测荧光强度,参数如下:
FAM-LEED-FMK :Ex/Em=490/525 nm
碘化丙啶:Ex/Em=535/635 nm
Hoechst 染料:Ex/Em=350/461 nm
流式细胞仪
使用530/30 nm滤光片(FITC通道)监测荧光强度(碘化丙啶染色,则使用610/20 nm滤光片(PE-Texas Red通道)。圈选目标细胞群,排除细胞碎片
荧光显微镜
将 100 µL 细胞悬液加入 96 孔黑色微量滴定板的每个孔中。在荧光显微镜下观察细胞,其中 FAM-AEVD-FMK使用 FITC 通道(碘化丙啶染色使用TRITC通道,Hoechst染色使用DAPI通道)。
荧光酶标仪
将 100 µL 细胞悬液加入 96 孔黑色微量滴定板的每个孔中。使用荧光酶标仪(底部读数模式)在 Ex/Em = 490/525 nm(截止波长 = 515 nm)处监测荧光强度。
注意:若需要平衡细胞浓度,可调整诱导组细胞的悬液体积,使其细胞密度接近未诱导组。如果细胞处理不会导致刺激组细胞数量大幅减少,此调整步骤可省略。