荧光量子产率测定试剂盒 适合于生物偶联基团
| Ex (nm) | - | Em (nm) | - |
| 分子量 | - | 溶剂 | - |
| 存储条件 | 在零下15度以下保存, 避免光照 |
产品货期
咨询
适用范围
适用于荧光蛋白偶联物、多肽、核苷酸及核酸的荧光量子产额测定
产品介绍
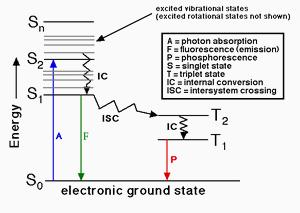
当荧光团吸收一个光子后,会形成能量激发态。该激发态的演变途径取决于荧光团的具体特性及其周围环境,但最终都会通过失活(能量损失)返回基态。主要失活过程包括:荧光发射(通过释放光子损失能量)、内转换与振动弛豫(以热能形式向周围环境非辐射耗散能量)、以及系间窜越至三重态后的非辐射失活。
荧光量子产额是指通过荧光发射的光子数与吸收光子数之比,换言之,量子产额表示激发态通过荧光而非其他非辐射机制失活的概率。荧光量子产率测定试剂盒提供生物偶联物荧光量子产额测定所需的所有核心组分,经过优化适用于荧光蛋白偶联物、多肽、核苷酸及核酸的荧光量子产额测定
样品实验方案
除非另有说明,所有未使用的储备液应在配制后分装成单次使用量,并于-20°C保存。应避免反复冻融。
请使用适当溶剂(如水或DMSO)配制1 mM的选定标准品及测试样品储备液。
表1. 试剂盒组分及其在水中的量子产额,并列示参比标准品选择的相似波长染料信息。
| 参考 | 水中的荧光量子产量 | 用以下染料或类似波长染料标记的缀合物(用于参考标准选择) |
| 参考1 | 0.98 | FAM, 6-TET, 6-HEX, 6-JOE, FITC, Cy®2, Alexa Fluor® 488 and 514, iFluor™ 488 and 514, DyLight™ 488, or other dyes that have an emission of 500 ± 50 nm |
| 参考2 | 0.20 | Cy3®, Alexa Fluor® 514, 532, 546 and 555, iFluor™ 514, 532 and 555, DyLight™ 555, TRITC, or other dyes that have an emission of 550 ± 50 nm |
| 参考3 | 0.44 | Texas Red®, Texas Red®-X, Alexa Fluor® 594, iFluor™ 594, California Red™, DyLight™ 594, or other dyes that have an emission of 600 ± 50 nm |
| 参考4 | 0.24 | Cy5®, Cy5.5®, Cy7®, Alexa Fluor® 633, 647, 700 and 750, iFluor™ 633, 647, 700 and 750, DyLight™ 650, 680 and 755, or other dyes that have an emission of 650 ± 50 nm |
样品实验方案
1.使用储备液经缓冲溶液(如PBS或TRIS)稀释后,记录选定标准品及测试样品(0.1-5 µM)的吸收光谱
2.根据最大吸收峰值选择激发波长。推荐按以下公式计算:
所需激发波长(nm) = 较短吸收峰值* - 50 nm*
从参比标准品或测试样品中选取。例如:若测试样品最大吸收峰为500 nm,选定参比标准品最大吸收峰为490 nm,则应选择440 nm(490 nm - 50 nm)作为激发波长
3.调整参比标准品与测试样品的浓度,使在选定激发波长下的吸光度保持一致(0.2-0.8之间)。
注:选择参比标准品与测试样品吸收光谱的等吸收点可能更简便
4.使用相同缓冲液或纯水将选定参比标准品与测试样品同步稀释10倍(必须保持相同稀释比例)
使用可生成校正荧光光谱的荧光分光光度计或酶标仪,在10 mm荧光比色皿中记录相同稀释溶液的荧光光谱。
注:所有荧光光谱必须在相同仪器设置下检测,更改仪器设置会导致量子产额测量结果无效