Cell Meter 细胞自噬检测荧光成像试剂盒
| Ex (nm) | - | Em (nm) | - |
| 分子量 | - | 溶剂 | - |
| 存储条件 | 在零下15度以下保存, 避免光照 |
产品货期
咨询
产品优势
可直接检测贴壁和悬浮细胞自噬过程
适用范围
用于细胞自噬检测
产品介绍
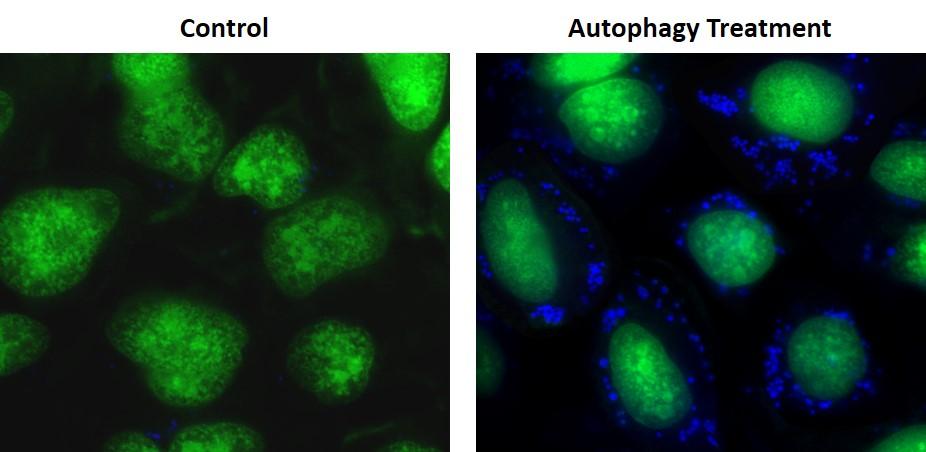
自噬是动物细胞内大分子物质降解的主要途径之一。该过程首先将细胞质成分和细胞器包裹在称为自噬体的膜性囊泡中,随后自噬体与溶酶体融合,最终降解被包裹的物质。
Cell Meter™自噬荧光成像检测试剂盒采用特异性自噬体标记物Autophagy Super Blue™来检测自噬活性。该试剂盒经过优化,可直接检测贴壁和悬浮细胞的自噬过程,提供完整的检测所需组分,特别适用于荧光显微镜观察,且比其他商业化的自噬探针具有更高的选择性。
适用仪器
| 荧光显微镜 | |
| Ex: | DAPI 滤波片组 |
| Em: | DAPI 滤波片组 |
| 推荐孔板: | 黑色透明底板 |
样品实验方案
简要概述
1.用您的测试化合物以1-2×104个细胞/孔的密度制备细胞
2.加入Autophagy Super Blue™工作液
3.在37°C孵育15-60分钟
4.用洗涤缓冲液洗涤细胞
5.检测荧光强度(激发/发射波长=330/520 nm,截止波长475 nm),或使用DAPI滤光片组荧光显微镜观察
溶液配制
工作溶液配制
将20 μL 500X Autophagy Super Blue™(组分A)加入10 mL染色缓冲液(组分B)中混匀,配制成Autophagy Super Blue™工作液。注意避光保存。
注:20 μL 500X Autophagy Super Blue™(组分A)可满足一个96孔板实验需求
实验步骤
1.根据您的特定诱导方案将细胞培养至适合自噬诱导的密度(约1-2×104细胞/孔/ 96孔板)。同时,设置未诱导的阴性对照组,保持相同细胞密度
2.除去培养基。
3.在每孔中加入100 µL /孔(96孔板)或25 µL /孔(384孔板)的自噬Super Blue 工作溶液。
4.将细胞在37°C,5%CO2培养箱中孵育15至60分钟。
注意:适当的孵育时间需根据细胞类型和浓度进行优化
5.用洗涤缓冲液(组分C)洗涤细胞3-4次,然后向每个孔中添加100 µL洗涤缓冲液(组分C)。
注意:若染色效果不佳,可适当提高染料浓度或延长孵育时间
6.检测荧光强度(激发/发射波长=330/520 nm,截止波长475 nm)
或使用DAPI滤光片组荧光显微镜观察