Cell Meter 活细胞Caspase 3/7和磷脂酰丝氨酸PS检测试剂盒
| Ex (nm) | - | Em (nm) | - |
| 分子量 | - | 溶剂 | - |
| 存储条件 | 在零下15度以下保存, 避免光照 |
产品货期
咨询
产品优势
1.通过结合外翻的PS,特异性监测细胞凋亡过程。
2.兼容荧光显微镜、流式细胞仪和荧光酶标仪三大检测平台
适用范围
用于细胞凋亡检测
产品介绍
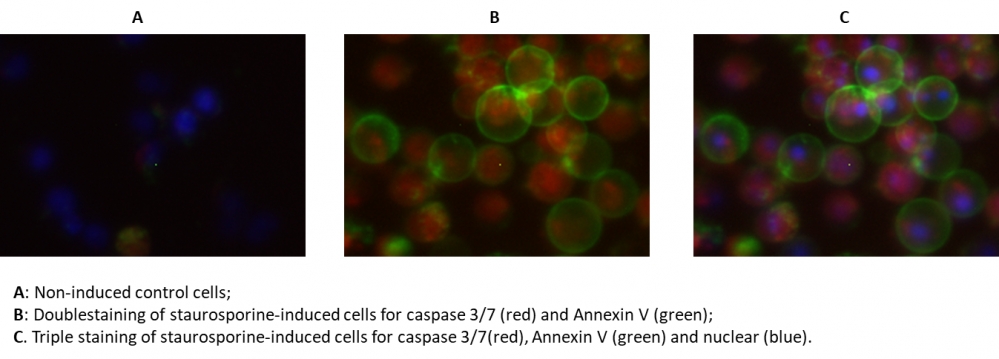
Cell Meter 活细胞Caspase 3/7和磷脂酰丝氨酸PS检测试剂盒是一套用于监测细胞功能的专业工具。在细胞凋亡过程中,半胱天冬酶(caspase)的激活是关键事件之一,其中caspase 3/7的活化对凋亡起始至关重要。研究表明,caspase 3/7对肽序列Asp-Glu-Val-Asp(DEVD)具有底物选择性。本试剂盒采用红色荧光标记物SR-DEVD-FMK作为caspase 3/7活性检测指示剂——该试剂具有细胞膜通透性且无毒,与caspase结合后可将荧光信号保留在细胞内。虽然这种结合会阻断caspase的进一步催化作用,但不会影响凋亡进程的持续推进。
膜联蛋白(Annexins)是一类钙离子依赖性磷脂膜结合蛋白,其中膜联蛋白V(Annexin V)可特异性检测细胞表面暴露的磷脂酰丝氨酸(PS)。PS外翻是凋亡早期/中期的普遍标志,而膜联蛋白V-荧光染料偶联物(Annexin V-dye conjugates)正是通过监测PS的转位来评估凋亡进程。本试剂盒提供的Annexin V-iFluor 488™绿色荧光标记试剂(激发/发射波长=490/525 nm),可与caspase检测同步实现哺乳动物细胞凋亡的双重监测。
试剂盒还包含用于全细胞核标记的Hoechst染料,以及坏死细胞染色剂碘化丙啶(propidium iodide),兼容荧光显微镜、流式细胞仪和荧光酶标仪三大检测平台。所有核心组分均经过优化,并提供标准化实验方案。
适用仪器
| 流式细胞仪 | |
| Ex: | 488 nm |
| Em: | 530/30 nm、575/26 nm、610/20 nm |
| 通道: | FITC, PE, PE-Texas Red 通道 |
|
荧光显微镜 |
|
| 推荐孔板: | 黑色透明底板 |
| 通道: | FITC 通道用于 Annexin V-iFluor 488™,TRITC 通道用于 TF3-DEVD-FMK |
|
荧光酶标仪 |
|
| Ex: | 490 nm, 550 nm |
| Em: | 525 nm, 595 nm |
| Cutoff: | 515 nm, 570 nm |
| 推荐孔板: | 黑色透明底板 |
| 读取模式: | 底读模式 |
样品实验方案
简要概述
1.细胞制备:调整细胞密度至2×10⁶ cells/mL
2.以1:150的比例添加TF3-DEVD-FMK和/或Annexin V-iFluor 488,以1:100的比例添加到细胞溶液中
3.将细胞在37°C,5%CO2培养箱中孵育1小时。
4.沉淀细胞,用缓冲液或生长培养基洗涤并重悬细胞
5.检测荧光强度(底部读数模式),参数设置如下
荧光酶标仪
Annexin V-iFluor 488™:激发/发射=490/525 nm(截止波长515 nm)
TF3-DEVD-FMK:激发/发射=550/595 nm(截止波长570 nm)
荧光显微镜:
FITC滤光片组:检测Annexin V-iFluor 488™
TRITC滤光片组:检测TF3-DEVD-FMK
流式细胞仪:
FL1通道:检测Annexin V-iFluor 488™
FL2通道:检测TF3-DEVD-FMK
细胞制备指南详见:
https://www.aatbio.com/resources/guides/cell-sample-preparation.html
储备溶液配制
TF3-DEVD-FMK储备溶液(150X):
向TF3-DEVD-FMK(组分A)中加入75 µL DMSO,制成150X TF3-DEVD-FMK储备液。
实验步骤
1.根据特定诱导方案将细胞培养至最合适密度(悬浮培养不超过2×10⁶ cells/mL;96孔黑色透明底板培养不超过3×10⁵ cells/100 µL/孔),同时为每个标记条件设置相同密度的未诱导阴性对照组。以下是悬浮培养细胞凋亡诱导的典型方案示例:
2.Jurkat细胞:2 µg / ml喜树碱处理3小时。
1 µM星形孢菌素处理3小时。
HL-60细胞: 4 µg / ml喜树碱处理4小时。
1 µM星形孢菌素处理4小时。
注意:需根据细胞系特性单独评估最合适诱导密度
3.按1:150比例加入150X TF3-DEVD-FMK储存液 或者 按1:100比例加入Annexin V-iFluor 488™(组分B)添加到每个孔中。
4.将细胞在37°C,5%CO2培养箱中孵育1小时。
注意:TF3-DEVD-FMK标记,细胞浓度可调整至~5×10⁶ cells/mL。贴壁细胞,使用0.5 mM EDTA温和消化细胞以保持完整性,标记前需用含血清培养基洗涤1次。具体孵育时间需根据细胞类型和浓度进行调整,建议每次实验前进行条件优化
贴壁细胞的膜联蛋白V流式检测非标准方案(细胞收获过程可能导致膜损伤);贴壁细胞流式检测方法可参考Casiola-Rosen及van Engelend等建立的方案
5.如果需要,用DNA染料标记细胞(例如,整个细胞核染色,使用Hoechst,或者仅用Annexin V-iFluor 488™标记的死细胞,使用碘化丙啶)。
6.在约200g下离心细胞2分钟,并用1mL(或96孔板,则每孔200uL)洗涤缓冲液(成分E)洗涤细胞两次。将细胞重悬在所需的洗涤缓冲液量中。
注意:TF3-DEVD-FMK与Annexin V-iFluor 488™均为荧光标记物,需充分洗涤去除未结合试剂以降低背景干扰。 悬浮细胞应调整至2-5×10⁵ cells/100 µL(适用于微孔板检测)。
7.通过荧光显微镜、流式细胞仪或荧光酶标仪监测荧光强度,具体参数如下:
TF3-DEVD-FMK 的激发波长 / 发射波长(Ex/Em)为 550/595 nm
膜联蛋白 V - iFluor 488™(Annexin V-iFluor 488™)为 490/525 nm
Hoechst 染色剂为 350/461 nm,
碘化丙啶(propidium iodide)为 535/635 nm。
流式细胞仪
FL1 通道监测 Annexin V-iFluor 488™的荧光强度
FL2 通道监测 TF3-DEVD-FMK 的荧光强度。圈选目标细胞群,排除细胞碎片。
荧光显微镜
将100 µL细胞悬液放入黑色96孔板的每个孔中。 在荧光显微镜下观察细胞,其中 TF3-DEVD-FMK 使用 TRITC 通道,Annexin V-iFluor 488™使用 FITC 通道(碘化丙啶染色使用 TRITC 通道,Hoechst 染色使用 DAPI 通道)
荧光酶标仪
将 100 µL 细胞悬液加入 96 孔黑色微量滴定板的每个孔中。使用荧光酶标仪(底部读数模式)监测荧光强度:Annexin V-iFluor 488™的激发波长 / 发射波长(Ex/Em)为 490/525 nm(截止波长 = 515 nm),和 / 或 TF3-DEVD-FMK 的激发波长 / 发射波长为 550/595 nm(截止波长 = 570 nm)
注意事项:
若需要平衡细胞浓度,可调整诱导组细胞的悬液体积,使其细胞密度接近未诱导组。如果细胞处理不会导致刺激组细胞数量大幅减少,此调整步骤可省略。