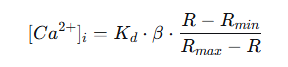如何使用Fura-2AM定量胞内的钙离子浓度?
|
摘要 钙成像技术(Calcium Imaging)因其高时空分辨率成为研究钙信号的主流方法。其中,Fura-2 AM 作为一种比率型荧光探针,通过双波长激发下的荧光比值变化实现对细胞内钙浓度的定量测量,有效克服了染料分布不均、细胞厚度差异等干扰因素。本文基于 Barreto-Chang 与 Dolmetsch (2009) 发表于 Journal of Visualized Experiments 的经典实验流程,系统介绍使用 Fura-2 AM 进行钙成像的实验设计、操作步骤、数据校准与分析方法,希望该内容可以帮助大家准确实现钙信号的定量化研究。(文献中含有视频可供查看。)
一、Fura-2AM的工作原理与优势 Fura-2 AM 是 Fura-2 的乙酰甲酯衍生物,具细胞膜通透性。进入细胞后,被胞内酯酶水解为 Fura-2 游离酸,无法逸出细胞膜,从而实现对胞内钙离子的特异性响应。Fura-2 的最大特点在于其激发光谱随钙离子结合发生位移:无钙时最大激发波长为 380 nm,结合钙离子后最大激发波长移至 340 nm,发射光峰值始终稳定在 505 nm 附近。
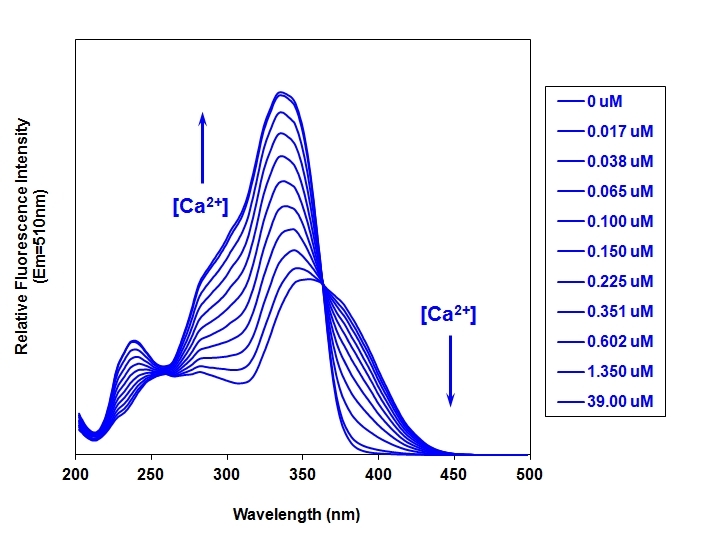
图1. 该图含有0至39微摩尔游离钙离子的溶液中Fura-2的荧光激发光谱
比率法(Ratiometric)计算(R = F₃₄₀ / F₃₈₀)具有三大优势: ①抵消浓度差异:比值与染料浓度无关,避免因细胞负载效率不同导致的信号偏差; ②减少光学伪影:消除光路长度、光照强度波动、细胞厚度不均等因素的影响; ③直接定量钙浓度:通过标准公式将比率值 R 转换为准确的细胞内钙离子浓度([Ca²⁺]ᵢ)。
二、文献实验流程 1.细胞准备与染料加载 ①基底处理:细胞需培养在 #1 玻璃盖玻片上,并使用多聚赖氨酸(Poly-L-Lysine)或层粘连蛋白(Laminin)进行包被,以增强细胞粘附,防止成像过程中细胞移动或脱落。 ②染料加载: a.将 Fura-2 AM 粉末用无水 DMSO(建议使用氮气密封包装以防止吸水)配制成 1 mM 储存液。分装后于 -20°C 干燥避光保存,可稳定数月。 b.实验时,用不含酚红的培养基(酚红会增加背景荧光)将储存液稀释至工作浓度(1–4 μM)。对于皮层神经元,通常使用 1 μM 工作液。 c.将细胞在37°C避光条件下孵育 30 分钟。 d.用预温的新鲜培养基洗涤细胞 1-2 次,以去除胞外未进入细胞的染料,然后在新鲜培养基中避光恢复 15-30 分钟,确保胞内酯酶将 AM 酯充分水解。
2.成像系统配置 一个典型的比率钙成像系统包括: ①倒置荧光显微镜(如 Nikon Eclipse TE2000-U) ②氙灯光源(如 Sutter Instruments) ③高速激发滤光轮:配备 340 nm 和 380 nm 窄带滤光片(如 Ludl) ④高数值孔径物镜(如 Nikon CFI Plan Fluor 40× Oil, NA 1.3) ⑤冷却CCD相机(如 Hamamatsu Orca-II)
3.图像采集与比率计算 ①背景扣除:在无细胞区域选取多个 ROI,测量其在 340 nm 和 380 nm 下的平均荧光强度(F_bkgd340, F_bkgd380),并在后续计算中从每个像素点的荧光值中减去。 ②采集双波长图像:对同一视野,依次快速采集 340 nm 和 380 nm 激发下的图像(F₃₄₀, F₃₈₀)。曝光时间通常设置在 50-200 ms,以避免光毒性和染料漂白。 ③计算比率图像:软件根据公式 R = (F₃₄₀ - F_bkgd340) / (F₃₈₀ - F_bkgd380) 生成比率图像(Ratio Image)。
三、从比率(R)到钙浓度([Ca²⁺]ᵢ)的定量转换 1.计算公式: 将比率值 R 转换为绝对钙浓度需使用 Grynkiewicz 公式:
其中: :Fura-2 与 Ca²⁺ 的解离常数,约 224 nM(生理条件下,不同实验室略有差异)。 :实验测得的 340 nm/380 nm 荧光比率。 :在零钙(Ca²⁺-free)条件下测得的比率。 :在钙饱和(Saturating [Ca²⁺])条件下测得的比率。 :定义为 F₃₈₀,min / F₃₈₀,max,即 380 nm 激发下,零钙与钙饱和时的荧光强度比值。(注:我们的产品说明书中命名为Q,在该公式中意义相同)
2.系统校准: 获取准确的 Rmin, Rmax, β 值至关重要,校准方法分为两种: ①体内校准(In vivo Calibration):精度高但技术难度大。需使用膜片钳技术向细胞内灌注已知浓度的钙缓冲液(如 10 mM BAPTA 用于 Rmin,10 mM CaCl₂ 用于 Rmax),同时进行成像测量。 ②体外校准(In vitro Calibration):操作简便,更为常用。在含有不同已知游离钙浓度(0 - 39 μM)的缓冲液中加入 Fura-2 游离酸(盐)(我们的货号是:21025/21026),在相同的显微镜设置下测量各溶液的 R 值,绘制标准曲线,进而拟合出 Rmin, Rmax, β和 有效 Kd。
四、数据分析与结果呈现 1.定义感兴趣区域(ROI):在比率图像上圈定单个细胞胞体或特定亚细胞区域。 2.提取时间序列数据:软件可输出每个 ROI 在每一个时间点的平均比率值 R(t)。 3.转换为钙浓度:将 R(t) 代入 Grynkiewicz 公式,计算得到每一时刻的 [Ca²⁺]ᵢ(t)。 4.绘图与统计分析: ①绘制 钙瞬变曲线([Ca²⁺]ᵢ - Time Trace),显示细胞对刺激(如高钾、药物)的反应。 ②对多次重复实验的曲线进行对齐、平均,计算平均响应峰值、上升时间、衰减时间常数等参数。 ③使用统计方法(如 t-test, ANOVA)比较不同实验组间的差异。
文献支持:Calcium Imaging of Cortical Neurons using Fura-2 AM - PMC |